牛津大学的科学家构建了一个互联的“多类器官”平台,可以重现心脏的免疫募集,为探索疾病和测试疗法开辟新的途径。
人体多器官类器官平台:破解心脏损伤免疫动态研究的关键难题
近日,一篇题为《Human Multi-Organoid Platform to Model Immune Dynamics in Cardiac Injury and Disease》的研究通讯发表于美国心脏协会旗下权威期刊《Circulation Research》。
该研究由牛津大学、伯明翰大学、赫尔大学等机构的科研团队(Jasmeet S. Reyat、Yuqi Shen、Abdullah O. Khan 等)共同完成,创新性地开发出一种整合心脏与骨髓类器官的体外培养平台,成功模拟了心脏缺血损伤后的免疫动态变化与组织重塑过程,为心脏疾病研究提供了更贴近人体生理环境的 “微型实验室”。

研究背景:为何需要新的心脏模型?
心脏损伤(如心肌梗死、心肌炎)后的修复过程,本质是免疫细胞与心脏组织的 “协同作战”,免疫细胞会募集到损伤部位,清除坏死细胞、促进组织再生,但过度激活也可能引发炎症失控和纤维化,最终导致心力衰竭。过去,科研人员主要依赖两种研究工具:动物模型和单心脏类器官模型。
动物模型(如小鼠)虽能模拟部分病理过程,但人与动物的免疫机制、基因表达存在显著差异,很多在动物身上有效的药物,进入人体临床试验后往往失败;而传统的人体体外心脏模型(如单心脏类器官),仅聚焦于心脏组织本身,完全忽略了 “循环免疫细胞募集” 和 “骨髓 - 心脏交叉调控” 这两个核心环节,骨髓是免疫细胞的 “发源地”,心脏损伤后,骨髓会释放免疫细胞进入循环,再迁移到心脏参与修复,这种 “跨器官对话” 是体内修复的关键,但此前的模型根本无法还原这一过程。
“缺乏能模拟免疫募集和骨髓 - 心脏交互的人体体外平台,是心脏损伤研究的最大瓶颈。” 研究团队在文中指出,正是为解决这一问题,他们设计了全新的多器官类器官平台。
平台设计:如何在实验室 “复刻” 心脏与骨髓的协同?
这个平台的核心,是一个 “3D 打印的流体连接装置”,它被放在常见的 6 孔细胞培养板中,内部同时容纳两种关键 “微型组织”,血管化心脏类器官(VCO)和骨髓类器官(comBO),再通过培养箱摇床驱动液体流动,模拟人体血液循环,让两种类器官实现细胞和信号分子的交换。
血管化心脏类器官(VCO):相当于 “微型心脏”,由研究团队此前开发的模型优化而来,不仅包含心肌细胞,还带有血管结构(如微血管内皮细胞),能更真实地模拟心脏的生理功能,也能像真实心脏一样对缺血(缺氧)产生反应。
骨髓类器官(comBO):相当于 “免疫细胞工厂”,基于团队近期发表的技术,由诱导多能干细胞分化而来,能持续产生多种免疫细胞,包括先天免疫细胞(如单核细胞、巨噬细胞)和适应性免疫细胞的前体,完美复刻了骨髓产生免疫细胞的功能。
简单来说,这个装置通过 “流体流动” 模拟血液运输,让 VCO(心脏)在损伤后能像体内一样,“召唤” comBO(骨髓)产生的免疫细胞迁移过来,从而还原 “损伤 - 免疫募集 - 修复” 的完整链条。
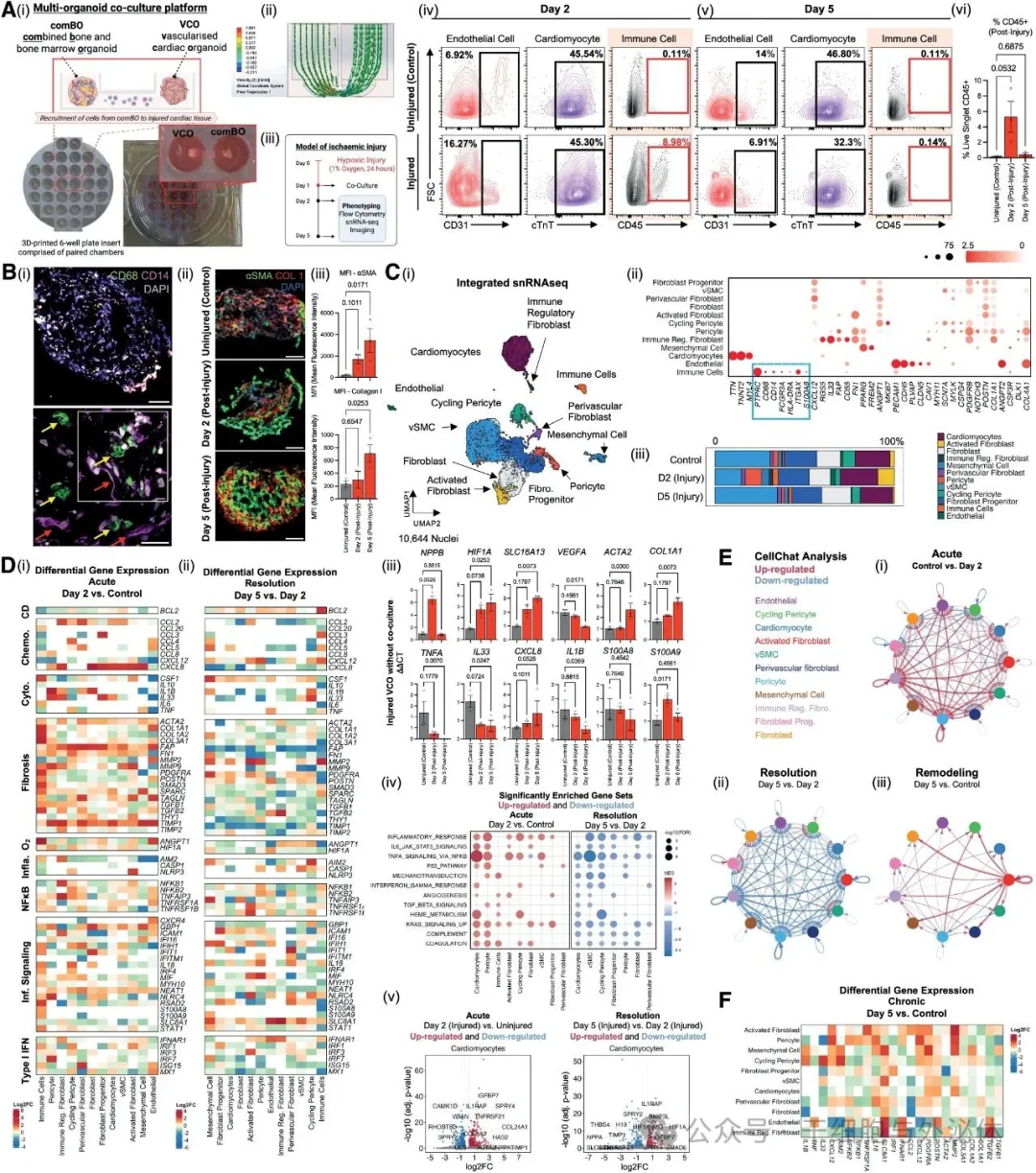
图.心脏-骨髓共培养平台的设计和验证。
实验验证:这个平台能还原心脏损伤的真实过程吗?
为测试平台的有效性,研究团队模拟了临床中常见的 “心脏缺血”(如心肌梗死时的供血不足):先给 VCO 施加 “缺氧压力”(1% 氧气环境,持续 24 小时,模拟心脏缺氧缺血状态),随后将其与 comBO 放入装置中共培养 5 天,分别在损伤后的第 2 天(急性损伤期)和第 5 天(修复缓解期)取样分析,用流式细胞术、免疫荧光、单核 RNA 测序等技术 “拆解” 病理变化。
1. 免疫细胞:损伤后 “精准募集”,随修复回归平稳
流式细胞术结果显示,损伤后第 2 天,VCO 中出现了大量 CD45 + 免疫细胞(这是免疫细胞的标志性分子),占比明显升高;而到了第 5 天,这些免疫细胞数量又回到了接近正常的水平。更关键的是,未受损伤的 VCO 中完全没有 CD45 + 细胞,这说明,平台中免疫细胞的募集是 “损伤特异性” 的,和人体中 “只有受伤才会召唤免疫细胞” 的规律一致。
免疫荧光进一步观察到,第 2 天的 VCO 中,还出现了 CD14 + 单核细胞和 CD68 + 巨噬细胞,这两种细胞是心脏损伤后最早到达的 “修复部队”:单核细胞会分化为巨噬细胞,清除坏死的心肌细胞,为后续修复铺路,这与人体心脏损伤的真实免疫反应完全吻合。
2. 组织变化:损伤引发纤维化,基因表达随阶段 “切换”
心脏损伤后,最常见的后遗症是 “纤维化”(心肌被胶原纤维替代,导致收缩功能下降)。研究团队通过免疫荧光发现,损伤后的 VCO 中,αSMA(平滑肌肌动蛋白,纤维化的标志)和 1 型胶原(构成纤维组织的主要成分)的含量明显增加,且随时间推移持续上升,这说明平台不仅能模拟免疫反应,还能还原心脏损伤后的纤维化过程。
单核 RNA 测序则揭示了更精细的 “基因开关”:第 2 天(急性损伤期),VCO 中与缺氧(HIF1A)、炎症(IL1B、NFKB1)、纤维化(TGFB1、COL1A1)、免疫细胞招募(CXCL8、CCL2)相关的基因全部 “上调”(活性增强),就像人体心梗后 “紧急启动修复程序”;而到了第 5 天(缓解期),这些基因的活性又显著 “下调”,只有与长期组织重塑相关的基因(如 IL18、MMP2)仍有异常,这意味着,平台能清晰呈现 “急性损伤→炎症缓解→组织重塑” 的完整阶段,与人体心脏损伤后的病理进程高度一致。
更重要的是,测序还识别出了心肌细胞特有的 “疾病相关基因”,比如 IGFBP7、HIF1A 等,这些基因在人类缺血性心脏病患者的心肌中也会异常表达,说明这个平台不是 “实验室里的玩具”,而是能真实反映人类疾病状态的模型。
研究意义:为心脏疾病研究打开新大门
这项研究的核心价值,在于它填补了心脏研究领域的 “关键空白”,首次在人体体外模型中,实现了 “心脏 - 骨髓 - 免疫” 的跨器官协同模拟。它的意义主要体现在三个方面:
第一,替代动物模型,减少 “物种差异” 干扰。由于平台使用的是人体细胞来源的类器官,模拟的是人体特有的免疫和病理过程,未来用它测试药物时,结果会比动物模型更可靠,能大幅降低临床试验的失败率。
第二,助力机制研究,破解 “修复难题”。过去无法研究骨髓免疫细胞如何影响心脏修复,现在通过这个平台,科研人员可以直接观察 “免疫细胞什么时候来、来了之后做什么、哪些基因在调控这个过程”,比如为什么有些患者损伤后会出现过度纤维化,而有些不会,这些机制的破解,能为心衰等疾病找到新的治疗靶点。
第三,可扩展性强,适配更多疾病场景。研究团队表示,这个平台还能加入其他器官类器官(如肝脏、肾脏),模拟心血管疾病与其他器官的相互影响(比如心衰导致的肾损伤);也能用于研究心肌炎、遗传性心脏病等其他心脏疾病的免疫动态。
目前,研究团队已为该平台申请专利,测序数据和实验方法也将在发表后公开(GEO accession number: GSE305006),方便全球科研人员使用。正如团队在文中所说:“这个平台不仅是技术创新,更是为心脏损伤研究提供了‘人体化工具’,未来有望推动缺血性心脏病、心衰等疾病的机制突破和药物研发。”
从实验室里的 “微型心脏与骨髓”,到未来可能拯救千万患者的新疗法,这项研究让我们看到,精准模拟人体生理环境的类器官技术,正成为连接基础研究与临床应用的关键桥梁。



