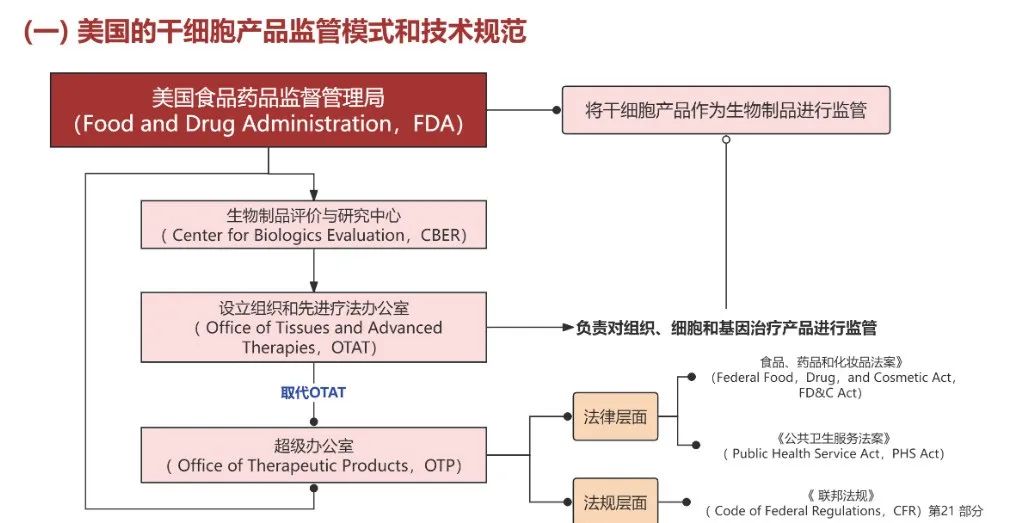
美国将干细胞产品归为生物制品,由食品药品监督管理局(FDA)负责监管,具体执行监管的是生物制品评价与研究中心(CBER)。美国对干细胞产品依据风险等级实施分类管理低风险产品可在医院直接应用(一般该疗法为胎盘干细胞疗法);高风险产品须由 FDA 审批(用于治疗罕见病、危重疾病等需提交新药申请(NDA),获得许可后方可进行)。
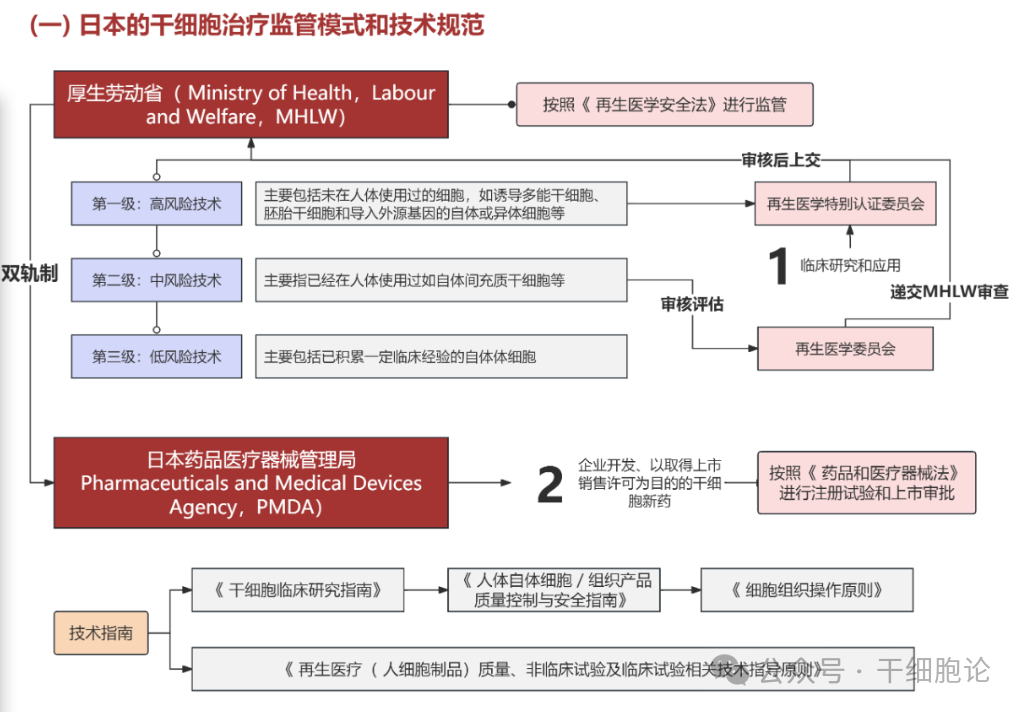
日本对干细胞治疗产品采取双轨制管理模式,和中国的监管方式很相似。
在医疗机构用于临床的细胞治疗产品,由医疗卫生管理部门审核批准;拟上市流通的产品,则按照药品管理规定进行管理。日本构建了法律、法规和指南构成的三级监管体系,为干细胞治疗产品研发和上市提供明确指引。在监管实践中,日本采取相对激进的策略,2014 年《再生医学安全确保法》创新性地推出条件性审批机制,允许在证明疗法 “预期收益大于风险” 的情况下,即便 Ⅲ 期临床试验未完成,也可获得限时许可。
大阪大学与理化研究所联合开发的自体 iPS 细胞衍生视网膜色素上皮细胞片(RIKEN - 001),凭借 12 例患者的 Ⅰ/Ⅱ 期临床试验中期数据(6 例视力改善,5 例稳定),于 2014 年获得全球首个 iPS 疗法有条件批准,且治疗费用被纳入医保。不过,这种 “先上车后补票” 的模式也引发争议,如日本生物治疗株式会社的 AlloStim - NK(异体脐带血来源 NK 细胞注射液)基于 Ⅱ 期数据上市后,跟踪发现部分患者出现严重不良反应,最终遭强制退市。

▲图源:大阪大学医学系研究科・医学部官网
第1级(高风险):涉及未应用于人体的胚胎干细胞、诱导性多能干细胞(iPS细胞)等前沿技术,需经“特别认定再生医疗委员会”、厚生科学审议会及厚生劳动大臣共同审议;
第2级(中风险):针对已改变生物特性的自体细胞疗法,如自体脂肪干细胞治疗糖尿病、外周血干细胞移植治疗类风湿关节炎等,审批流程相对简化,主要由“特别认定再生医疗委员会”负责;
第3级(低风险):对于未改变原有特性的自体细胞处理,如自体免疫细胞治疗肿瘤、血浆血小板提取物治疗骨病、乳房切除术后利用脂肪干细胞重塑乳房等,仅需“再生医疗委员会”的审查即可。
欧盟将干细胞纳入先进治疗医学产品(ATMPs)范畴,作为医药产品进行监管,审批和管理工作由欧洲药品管理局(EMA)负责。同时,存在医院 “豁免条款”,医疗机构可依据各国法规,决定在本国生产和使用干细胞治疗产品,但仅限在本国范围内应用。
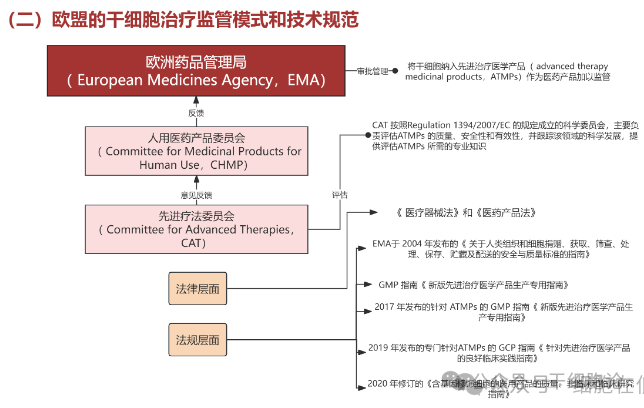
按照欧盟规定,ATMPs 产品上市许可需由 EMA 下属的人用医药产品委员会(CHMP)和先进疗法委员会(CAT)审评。CAT 负责评估 ATMPs 的质量、安全性和有效性,并跟踪该领域科学发展,为评估提供专业知识支持。评估过程中,CAT 起草意见并提交给 CHMP,CHMP 基于此作出建议,最终由欧盟委员会作出决定。欧盟通过相关法规,为干细胞治疗产品全产业链提供法律监管框架,并制定详细规范和指南。
2025 年 2 月 21 日,韩国修订版《先进再生生物法》正式生效,标志着干细胞治疗在韩国迎来重大政策调整。根据该法案,患有 “严重、罕见或无法治愈” 疾病的患者,即便未参与临床研究,只要相关干细胞、免疫细胞及基因疗法通过安全性和有效性验证(处于研究阶段),即可接受治疗,并且医疗机构或企业首次被允许收取治疗费用以覆盖成本。但法案明确禁止此类疗法用于美容或抗衰老等非医疗目的。
《朝鲜日报》新闻截图
为保障治疗安全有效,医疗机构在实施治疗前,必须向由韩国卫生福祉部和食品药品安全部共同设立的再生医学审查委员会提交详细治疗计划,获批后方可开展治疗。韩国将生物技术列为 “先进战略技术支持计划” 的四大核心产业之一,2025 年相关政策融资规模达 25.5 万亿韩元(约人民币 1285 亿元),大力推动干细胞疗法等生物技术研发与临床应用。
在我国,干细胞治疗监管采取双轨制。以上市为目的的干细胞产品,需遵循药品管理相关法规进行研发和注册申报上市;非上市目的的干细胞技术,可在国家卫生健康委员会完成干细胞临床研究机构备案和临床研究项目备案的基础上,在医疗卫生机构内开展临床研究。
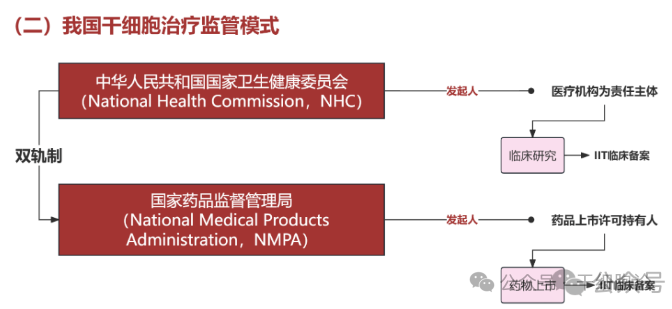
近年来,我国持续完善干细胞治疗监管体系,国家药监局药审中心(CDE)陆续发布 30 多项细胞及基因治疗相关技术指南,覆盖研发、注册、生产到上市后全生命周期,有力推动我国干细胞治疗成果转化及产业规范发展。今年年初,我国首款干细胞药物艾米迈托赛注射液(睿铂生)获批上市,在间充质干细胞治疗移植物抗宿主病领域取得突破。
总体而言,全球各国基于自身国情和医疗体系,对干细胞治疗构建了各具特色的监管模式。
随着干细胞技术的不断发展,各国监管机构也在持续优化监管策略,力求在促进技术创新与保障公众健康之间寻求平衡。对于患者和从业者而言,深入了解不同国家的监管政策,是合理应用干细胞治疗技术、推动产业健康发展的重要前提。



